细胞衰老
一、细胞衰老的概念
细胞衰老(cellular aging或cell senescence)是指随着时间的推移,细胞的增殖能力和生理功能逐渐发生衰退的变化过程。衰老的细胞呈现出一种不可逆的生长停滞状态,其最终结果将导致细胞死亡。
细胞衰老是生物个体衰老的细胞基础,个体的自然衰老并不是疾病,但它与许多老年性疾病紧密关联。
(一)细胞衰老与机体的衰老既有区别又有联系
机体衰老是指绝大多数生物性成熟以后,机体形态结构和生理功能逐渐退化或老化的过程,是一个受发育程序、环境因子等多种因素控制的、不可逆的生物学现象。机体的衰老与其物种的寿命密切相关。
对多细胞生物来说,细胞的衰老与机体的衰老是两个不同的概念。个别细胞,甚至机体局部许多细胞的衰老与死亡并不影响机体的寿命;同样,机体衰老并不代表所有细胞的衰老,如70岁老人的生精细胞仍可以活跃地发生。
同时,机体衰老与细胞衰老之间又有着密切的联系。个体的衰老是建立在总体细胞衰老的基础上的,各种衰老都有其细胞学基础,如老年人运动功能衰退与其体内的运动神经元的衰老密切相关。
(二)机体内各类细胞的寿命不同
在成年体内的组织器官中总有细胞不断地衰老,不同类型细胞的寿命很不一致。除干细胞外,根据寿命情况将细胞分为三类:
- 第一类细胞的寿命接近于动物的整体寿命,如神经元、脂肪细胞、肌细胞等;
- 第二类是缓慢更新的细胞,其寿命比机体的寿命短,如肝细胞、胃壁细胞等;
- 第三类是快速更新且寿命较短的细胞,如皮肤的表皮细胞、红细胞和白细胞等。
(三)细胞在体外培养条件下的寿命
离体(in vitro)细胞与在体(in vivo)细胞一样,也有一定的寿命。对于体外培养的细胞,其寿命长短取决于培养细胞的平均代数,并与所取培养细胞的组织年龄、种属等特性密切相关。
1961年, Hayflick首次报道了体外培养的人成纤维细胞(fibroblast)具有增殖分裂的极限,即Hayflick界限(Hayflick life span)。他利用来自胚胎和成体的成纤维细胞进行体外培养,发现胚胎的成纤维细胞分裂传代50次后,进入生长停滞状态;而来自成年组织的成纤维细胞只能培养15~30代就开始出现生长停滞。
Hayflick等还发现,动物体细胞在体外可传代的次数,与物种的寿命有关。同时,细胞分裂能力与个体的年龄有关。由于上述规律是Hayflick发现的,故称为Hayflick界限。
二、细胞衰老的表现
细胞衰老的主要表现是对环境变化的适应能力,以及维持细胞内环境稳定的能力降低。这些都是以细胞的形态结构和生化方面的改变为基础的。
(一)细胞衰老伴随着形态学改变
衰老细胞的形态变化主要表现在细胞皱缩、膜通透性和脆性增加、核膜内陷和细胞器数量减少,特别是线粒体数量减少,胞内出现脂褐素等异常物质沉积,最终出现细胞凋亡或坏死。通常衰老细胞的各种结构呈退行性变化。
(二)细胞衰老过程中有生物大分子和代谢的改变
衰老细胞会出现脂类、蛋白质和DNA等细胞成分损伤,细胞代谢能力降低,主要表现在以下方面:
1.DNA
复制与转录受到抑制,但也有个别基因会异常激活,端粒DNA丢失,线粒体DNA特异性缺失,DNA氧化、断裂、缺失和交联,甲基化程度降低。
2.RNA
mRNA和tRNA含量降低。
3.蛋白质
含量下降,细胞内蛋白质发生糖基化、氨甲酰化、脱氨基等修饰反应,导致蛋白质的稳定性、抗原性和可降解性下降,自由基使蛋白质肽键断裂,交联而变性。氨基酸由左旋变为右旋。
4.酶分子
活性中心被氧化,金属离子丢失,酶分子的二级结构、溶解度和等电点发生改变,总的效应是酶失活;但β-半乳糖苷酶(senescence-associated β-galactosidase,SA-βgal)活性增强。
5.脂类
不饱和脂肪酸被氧化,引起膜脂之间或与脂蛋白之间交联,膜的流动性降低。
三、细胞衰老的学说与机制
(一)细胞衰老的学说
1.遗传决定学说
该学说认为衰老是遗传上的程序化过程,其推动力和决定因素是遗传的基因组:控制生长发育和衰老的基因都在特定时期有序地开启和关闭。
在人类,有两个典型的例子:一个是患婴幼儿早衰症(Hutchinson-Gilford syndrome)的儿童,患儿很早就出现明显的衰老症状。该病是由于编码核膜蛋白的基因突变所引起的,为常染色体隐性遗传疾病;另一个是成人早衰症(Werner syndrome)。引起该病的基因与DNA的解旋有关(患者的DNA不能够正常修复)。Werner早衰症,其体内8号染色体上编码DNA解旋酶的基因发生了突变,称为WRN基因,该基因是保证DNA复制所必需的基因,它的突变将引起衰老提前和寿命缩短。
迄今在人和动物体内已发现了多个与衰老有关的基因,根据其功能,可区分为衰老基因和抗衰老基因两大类。细胞衰老时,一些衰老相关基因(senescence associated gene)的表达水平显著高于年轻细胞。例如:p16基因,其基因产物是细胞周期依赖性激酶抑制因子(CKI),研究发现,细胞衰老时,p16基因mRNA的转录及蛋白质表达水平增高,p16表达增强将使细胞寿命缩短,抑制p16基因的表达,细胞的寿命则延长。由此,p16被视为细胞寿命的关键调控基因,是人类细胞衰老遗传控制程序中的关键效应物。
抗衰老基因也称长寿基因(longevity gene)。研究人员将蛋白质生物合成延长因子-1α(EF-1α)基因转入果蝇生殖细胞,结果发现子代果蝇的寿命延长了40%,说明EF-1α具有长寿作用。
2.自由基学说
认为活性氧基团导致细胞损伤和衰老。老年人皮肤上的老年斑(age spots)就是自由基对细胞破坏的见证。
自由基是指那些在原子核外层轨道上具有不成对电子的分子或原子基团。所谓未成对电子,是指在原子或分子轨道中未与其他电子配对而独占一个轨道的电子。如A、B两个原子各提供一个电子通过共价键形成一个分子A:B,这两个电子是配对的。如果在化学反应中发生了均裂,A和B各带走一个电子,它们就是未成对电子。A·和·B就称为自由基。
在正常条件下,人体内自由基的产生有两方面:一是环境中的高温、辐射、光解、化学物质等引起的外源性自由基;二是体内各种代谢反应产生的内源性自由基。内源性自由基是人体自由基的主要来源,其产生的主要途径有:
- 由线粒体呼吸链电子泄漏产生;
- 由经过氧化物酶体的多功能氧化酶(MFO)等催化底物羟化产生。
- 此外,机体血红蛋白、肌红蛋白中还可通过非酶促反应产生自由基。
自由基是一类高度活化的分子,当这种分子与其他物质反应时,力图得到电子,而对细胞及组织产生十分有害的生物效应。由于自由基活性强,容易与细胞内的生物大分子发生反应,过多的自由基会对许多细胞组分造成损伤。
- 它们能使质膜中的不饱和脂肪酸氧化,从而使膜内酶活性破坏、膜蛋白变性、膜脆性增加、膜结构发生改变,因而膜的运输功能紊乱以致丧失;
- 它们还能将蛋白质中的巯基氧化而造成蛋白质发生交联、变性,使酶失活。
- 另外,它们还能使DNA链断裂、交联、碱基羟基化、碱基切除等,从而对DNA造成损伤。
3.端粒钟学说
认为端粒随细胞分裂不断缩短为衰老的主要原因。[200 学习/201 细胞生物学/第08章 细胞核/第2节 染色质和染色体/染色质和染色体#(五)端粒|端粒]是染色体末端的一种特殊结构,其DNA由简单的串联重复序列组成。人的染色体端粒由TTAGGG/CCCTAA重复序列组成。
在细胞分裂过程中,由于端粒不能为DNA聚合酶完全复制而逐渐变短,除非有端粒酶的存在。端粒酶是一种由RNA和蛋白质组成的核糖核蛋白酶,常见于生殖细胞和肿瘤细胞等细胞中,而正常的体细胞中则缺乏端粒酶或端粒酶活性很低。
“有丝分裂钟”学说,或称“端粒钟(telomere clock)学说”认为,正常情况下,随着细胞的不断分裂,染色体末端的特殊结构“端粒”会逐渐缩短,当端粒缩短到一定程度时,细胞增殖停滞,发生细胞衰老。将人的端粒反转录酶亚基(hTRT)基因通过转染,引入正常的人二倍体细胞(人视网膜色素上皮细胞和成纤维细胞),发现表达端粒酶的转染细胞分裂旺盛,端粒长度明显增加,作为细胞衰老标志的β-半乳糖苷酶活性则明显降低,这些与对照细胞存在鲜明的差异,而且表达端粒酶的细胞寿命比正常细胞至少长20代,且其核型正常。此外,对提前衰老的克隆羊多莉的研究发现,其细胞中端粒的长度较同龄羊缩短20%。这些研究表明,端粒长度的确与衰老有着密切的关系。
端粒缩短诱发的细胞衰老为复制性衰老(replicative senescence)。
当然也有一些不支持这一学说的报道,在二倍体的仓鼠胚细胞分裂的各个阶段,细胞始终表达端粒酶,其端粒长度亦保持恒定,然而经过20~30代的分裂后,细胞仍然进入衰老;某些小鼠终生保持较长的端粒,但并未因此获得较长的寿命。特别是剔除端粒酶基因的小鼠,在其前5代中,并未观察到寿命缩短的现象。
尽管如此,目前人们根据端粒与端粒酶在细胞衰老上的研究成果,已将细胞衰老区分为两大类:
- 一类是与端粒、端粒酶直接相关的复制性衰老;
- 另一类是氧化应激诱导的非端粒依赖性衰老,也被称为早熟性衰老(premature senescence)。有研究者认为,某些终生保持较长端粒小鼠的衰老即属于氧化应激诱导的非端粒依赖性衰老。
4.代谢废物累积学说
代谢废物累积(waste product accumulation)学说是指由于细胞功能下降,一方面细胞不能将代谢废物及时排出胞外,另一方面又不能将其降解与消化,这样代谢废物越积越多,在细胞中占据的空间越来越大,影响细胞代谢废物的运输,以致阻碍了细胞的正常生理功能,最终引起细胞的衰老。
哺乳动物脂褐质的沉积是一个典型的例子。脂褐质是一些长寿命的蛋白质和DNA、脂类共价缩合形成的巨交联物,次级溶酶体是形成脂褐质的场所,由于脂褐质结构致密,不能被彻底水解,又不能排出细胞,结果在细胞内沉积增多,阻碍细胞的物质交流和信号传递,最后导致细胞衰老。在老年性痴呆患者脑组织中有大量β-淀粉样蛋白沉积,而β-淀粉样蛋白可作为老年性痴呆的鉴定指标。 #? 意味何在?
5.基因转录或翻译差错学说
随着年龄的增长,机体的细胞内不但DNA复制效率下降,而且常会发生核酸、蛋白质、酶等大分子的合成差错,这种逐渐累积的差错最终引起细胞功能降低,并逐渐导致细胞衰老、死亡,这就是细胞衰老的基因转录或翻译差错学说。
6.其他学说
除了上述学说外,还有“神经免疫网络论”“钙调蛋白学说”“微量元素学说”等。
(二)复制性细胞衰老和氧化应激诱导的非端粒依赖性细胞衰老的调控
细胞衰老的主要变化是细胞进入一种不可逆的生长停滞状态。迄今对细胞衰老分子机制的认识,主要来源于对细胞衰老过程中细胞增殖周期停滞在G1期和S期的衔接期机制的研究。G1/S期是真核细胞周期中重要的限制调控点,其中G1期限制点是增殖细胞唯一能够接受外界增殖和抑制信息的调控点。DNA复制发生在S期,在M期发生染色体的分离和胞质分裂,M期之后,细胞重返G0期而撤离细胞周期。研究表明,未能通过G1/S检查点的细胞也将退出细胞周期,并走向衰老(图16-3)。
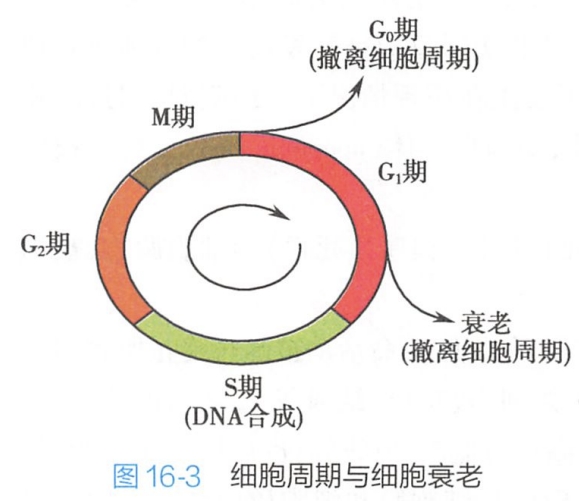
目前认为,主要有两条途径调控细胞的衰老:
- 一是复制性衰老的调控,它依赖于p53→p21、pRb→E2F信号通路的调控。在复制性衰老中,当细胞染色质末端端粒显著缩短时,p53被激活,促进p21Cip1/Waf1基因转录,p21Cip1/Waf1为一种CKI,它通过抑制Cdk的活性,使pRb蛋白磷酸化受阻,与S期相关的转录因子E2F不能被释放,DNA复制不能进行,细胞无法从G1期进入S期,导致细胞周期停滞;
- 二是氧化应激诱导的非端粒依赖性细胞衰老,它受ERK→p38MAPK→p16→pRb信号通路的调控。在氧化应激诱导的非端粒依赖性细胞衰老中,ERK的激活促使丝裂原启动激酶(MKK3和MKK6)的积累,进而激活p38MAPK,通过Cdk抑制因子p16影响Rb磷酸化而导致细胞周期停滞。